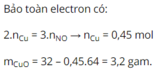Bài 1 Khi hòa tan 40,0 g hh gồm Cu và CuO trong 100ml dung dịch Hno3 lấy dư.Thấy thoát ra 8,96 lít khí No (đktc).
a, Tính% khối lượng trong hh đầu.
b, Tính CM dung dịch Hno3 cần dùng cho phản ứng
Bài 2
Đốt cháy hoàn toàn 9g hợp chất hữu cơ A(C,H,O) sản phẩm thu được hấp thụ lần lượt vào bình 1đựng dung dịch H2So4 đặc và bình 2 đựng dung dịch nước vôi trong dư thấy khối lượng bình 1 tăng lên 10,8gam và khối lượng bình 2 tăng 19,8 gam.tính % khối lượng mỗi nguyên tố trong A.